NICT、DNAを足場に利用した生体分子システム作製技術を開発。タンパク質モータ分子が狭い空間に集まると運動活性が上がる現象も発見 (発表資料)http://bit.ly/UYTdSQ pic.twitter.com/ftgsda4R
Image may be NSFW.
Clik here to view.
プレスリリース | DNAを足場に、パーツを混ぜるだけで生体分子システムをつくる | NICT-独立行政法人 情報通信研究機構
独立行政法人 情報通信研究機構(以下「NICT」、理事長:宮原 秀夫)は、将来の情報通信技術への応用を探る基礎研究として、生体分子の物性や機能の研究を行っており、その一環として、生体分子の自己組織能を活用した分子システム構築法と、それを利用した生体分子の集団としての動作原理を解明する研究を行っています。
今回、NICT(古田健也研究員、小嶋寛明室長ら)と、東京大学(豊島陽子教授)の研究グループは、DNAを足場として用いることで、生体分子のシステムをつくる技術を開発しました。構成部品を混ぜ合わせるだけで、あらかじめ設定しておいた数や並ぶ順番、間隔をもつタンパク質分子のシステムを一度に数多く作製するというものです。
さらに、この手法を用いて、生物の動きを司るタンパク質モータ分子システムを作製し、その運動を観測しました。その結果、モータの種類によって、複数の分子が集まるだけでお互いの活性を上げたり、システムに組み込まれるとごく一部のモータ分子だけが働くようになる現象を示すことを発見しました。本研究成果は、細胞内での物質輸送ならびに細胞骨格ネットワークの制御メカニズムの基本原理の理解 及び 分子情報通信デバイス構築技術の実現に向けた重要な知見となると考えられます。
なお、この成果は、2012年12月24日の週に、国際的科学誌 『米国科学アカデミー紀要(PNAS)』 オンライン速報版で公開されます。<http://www.pnas.org/papbyrecent.shtml>
背景生体分子は、生体内で複数分子のシステムを形成して働く場合がほとんどであり、システムを形成することで協調しながら効果的に機能を果たしています。細胞内での物質の輸送を司るタンパク質モータも例外ではなく、筋肉や鞭毛の運動、細胞小器官の輸送や細胞骨格ネットワーク構築の例に見られるように、複数の分子が協調して働いています。細胞内での物質輸送の向き、速度、効率を状況に応じて最適な状態に制御することは、細胞の生存にとって大変重要です。これらは輸送システムを構成するタンパク質モータの種類、状態、構成分子の数によってコントロールされます。
これまで、一分子レベルでのタンパク質モータの性質については、詳細に調べられてきました。しかし、複数分子の協調メカニズムについては、理論的な側面からの研究は行われてきましたが、生体分子の数と配置を正確に制御して分子システムを構築し、実験に用いることは困難であったため、研究の進展が妨げられていました。
今回の成果 Image may be NSFW.Clik here to view.
 DNAを足場とした生体分子システム
DNAを足場とした生体分子システム
今回、DNAの自己組織能を活用することで、構成パーツさえ用意すれば、一定の手順でそれらを混ぜるだけで、所望する構成の生体分子システムを作製できる手法を考案し、組み込まれるタンパク質分子の数と配置を制御した生体分子システムを作製することに成功しました。
さらに、この手法を細胞内での物質輸送や運動を司るタンパク質モータ分子に適用し、DNAの足場上に分子数や分子間隔を制御したタンパク質モータ分子(kinesin-1,Ncd)を用いた、生体分子システムを作製しました(図参照)。基板表面に固定したレールの役割を持つタンパク質フィラメント(微小管)上でのそれらの運動を蛍光顕微鏡下で観測した結果、生体分子システムを構成する分子の数を1個から2個に増やす、あるいはシステムを構成する分子の間隔を狭くするだけで、運動効率が著しく上昇することを見出しました。また、微小な力を測定できる特殊な光ピンセット装置を用いてシステム全体が発生する力を測定したところ、kinesin-1は、分子を何個か集めても、常に1個分の力しか出さないことを明らかにしました。
今回の結果は、複数のタンパク質モータ分子が狭い空間に詰め込まれると、それだけでお互いの運動の活性を上げたり、システムを構成する分子の数の変動に対しても安定して力を出したりする自己調整機能を有することを示しており、細胞内での物質輸送や細胞骨格ネットワーク形成に際して、タンパク質モータの離合集散の果たす役割を理解する上で重要な手がかりを与えるものです。
今後の展望基礎研究の観点からは、今回の成果を、鞭毛運動モデル、筋収縮モデルや細胞骨格ネットワーク生成モデルなど、多数の分子が協調して働く生体システムを人工的に再構成するための手法として発展させ、その動作メカニズムの理解を深めるために活用することが期待されます。応用的な観点からは、タンパク質分子をこれまでにない高い精度で配置し、システム化することを通じ、受容体タンパク質を利用したセンサやタンパク質モータを利用したアクチュエータなど、生物の優れた機能をそのまま保有した、新しいデバイス構築を実現するための基盤技術としての活用が期待されます。
なお、この研究成果は、2012年12月24日の週に、『米国科学アカデミー紀要(PNAS)』オンライン速報版で公開されます。
Image may be NSFW.Clik here to view.
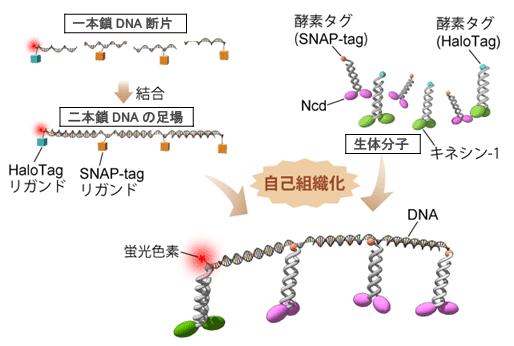
図1.自己組織的な分子システム構築法
酵素タグ(SNAP-tag, HaloTag)が認識する人工基質(リガンド)を導入した 一本鎖DNA断片 を、テンプレートとなるDNA鎖と塩基配列特異的に結合させ、 二本鎖DNAの足場 を形成する。 次に、酵素タグを末端にもつ 生体分子 と混合し、自己組織的に分子システムを構築する。
Image may be NSFW.
Clik here to view.
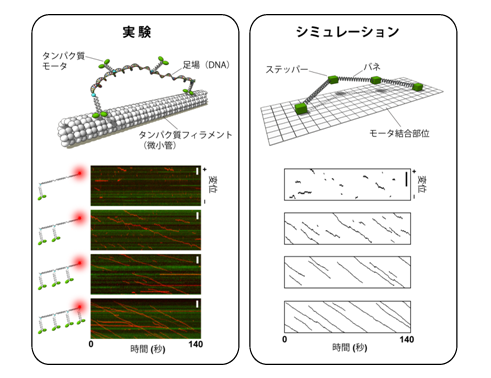
図2.DNAを足場としたタンパク質モータ分子システムの運動とモデルシミュレーション
(左)分子システムの模式図と微小管に沿った分子システムの運動軌跡:
システムを構成するタンパク質モータ分子(Ncd)の数が1個から2個になった途端、微小管に沿った連続運動がみられるようになった。赤いラインが運動の軌跡。
(右)モデルの概略とシミュレーションによって再現した運動軌跡:
構成分子が1個から2個に増えた際の運動連続性の大きな変化を再現できた。
(スケールバー:3μm)